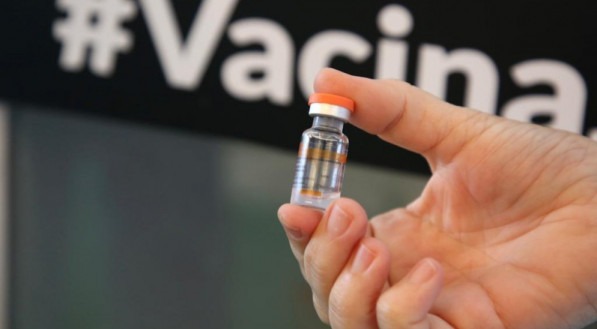
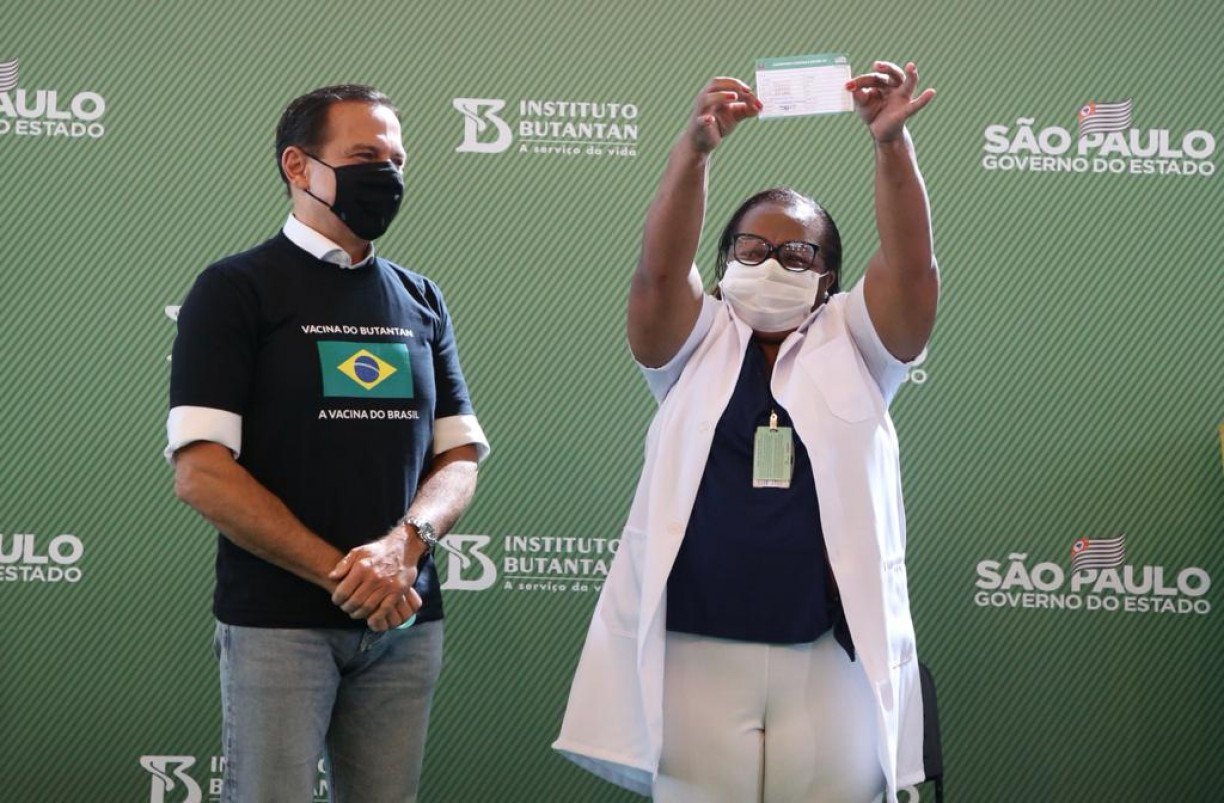
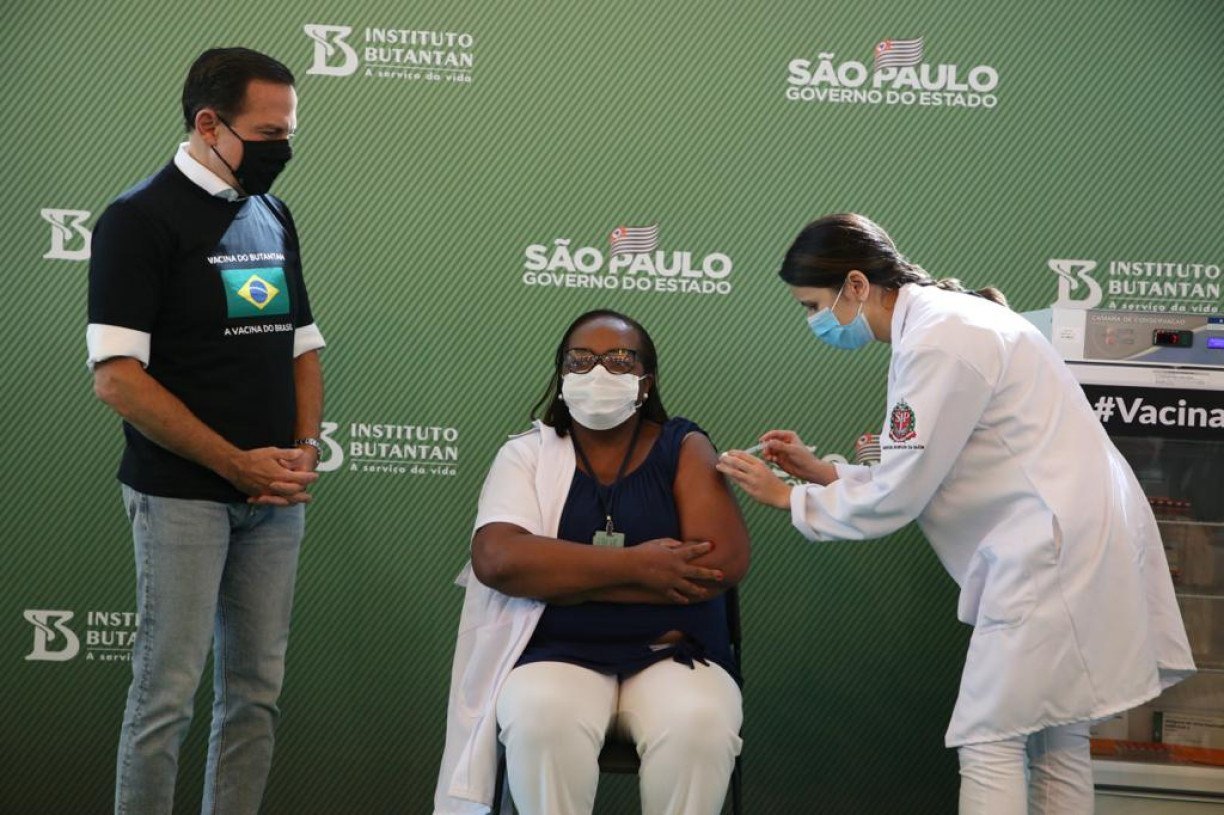
Mulher, negra e enfermeira é primeira no Brasil a receber dose de vacina contra covid-19
Enfermeira Mônica Calazans, de 54 anos, é moradora de Itaquera, São Paulo, com perfil de alto risco para complicações da covid-19







Aprovação da Anvisa
A diretoria colegiada da Agência Nacional de Vigilância Sanitária (Anvisa) aprovou, na tarde deste domingo (17), o uso emergencial das vacinas desenvolvidas pelo Instituto Butantan em parceria com a farmacêutica Sinovac, a Coronavac, e pela Fundação Oswaldo Cruz (Fiocruz) em parceria com a Universidade de Oxford com a Astrazeneca. Os cinco diretores votaram a favor do uso emergencial. A primeira a ler o voto foi a diretora relatora, Meiruze Freitas, seguida por Romison Mota, Alex Santos, e Cristiane Jourdan. O último a votar foi diretor-presidente, Antonio Barra Torres. A reunião durou cerca de 5 horas e 20 minutos.
Ao encerrar a reunião, Torres disse que é preciso confiar na Anvisa e nas vacinas que forem certificadas pela agência. "Quando ela estiver ao seu alcance, vá e se vacine." Ao ler o voto, o diretor-presidente da Anvisa ressaltou que, apesar da aprovação das vacinas em caráter emergencial, ainda é necessário manter os cuidados para evitar a disseminação do novo vírus, como o distanciamento social, uso de álcool em gel, lavagem correta das mãos e uso de máscara. "É com grande alegria e renovada esperança que acompanho a diretora relatora. É assim que voto", disse.
Antes da aprovação, os dois imunizantes já haviam recebido o parecer favorável da área técnica do órgão em razão "do cenário da pandemia, aumento do número de casos e ausência de alternativas terapêuticas".
- Prefeitos afirmam que Pazuello apontou 20 de janeiro como data de início da vacinação contra covid
- Celpe doa refrigeradores científicos para armazenar vacinas contra covid-19 em 136 cidades de Pernambuco
- Após Índia não confirmar entrega, voo que sairia do Recife para buscar vacina contra a covid-19 é adiado
- Covid-19: Índia satisfeita com início da campanha de vacinação
- Pernambucano toma segunda dose da vacina contra a covid-19 em Israel: "Me sinto muito feliz e tranquilo"
- Covid-19: área técnica da Anvisa recomenda aprovação da vacina Coronavac
- Área técnica da Anvisa recomenda aprovar uso emergencial da vacina de Oxford
Acompanhe a reunião
A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou, por unanimidade, neste domingo, 17, o uso emergencial da Coronavac e da vacina desenvolvida pela Universidade de Oxford e a farmacêutica AstraZeneca.
Em seu relatório, que foi acompanhado por todos os diretores, a relatora e diretora da Anvisa Meiruze Freitas incluiu que a decisão, com relação a Coronavac, deve passar a valer após a publicação do termo de compromisso e "subsequente publicação de seu extrato" em Diário Oficial da União.
Com relação à vacina de Oxford, o voto da diretora vale apenas para o uso das 2 milhões de doses que o governo ainda tenta importar da Índia. A decisão valeria após a publicação de extrato ou "ciência oficial" via ofício.
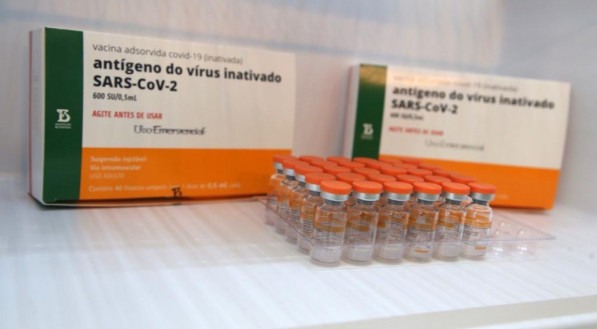
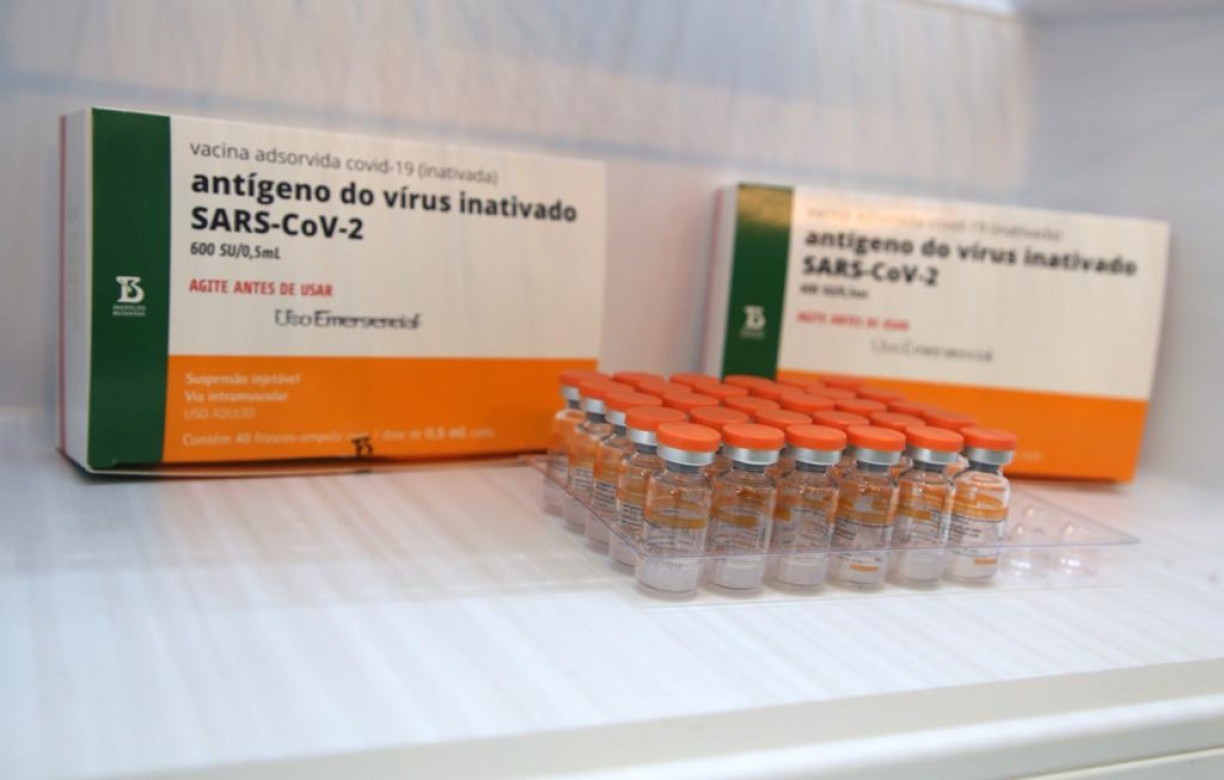
Coronavac
Desenvolvida pela farmacêutica chinesa Sinovac, a Coronavac será fabricada e distribuída no Brasil pelo Instituto Butantan. A Coronavac é o único imunizante contra a covid-19 com estoque no Brasil. A ideia é que 6 milhões de doses sejam disponibilizadas ainda em janeiro. A eficácia da vacina para evitar a manifestação da doença é de 50,39%, segundo atestou neste domingo a Anvisa.
O imunizante tornou-se alvo de briga política entre Doria e o presidente Jair Bolsonaro. O mandatário forçou, em outubro, o Ministério da Saúde a cancelar uma promessa de compra da Coronavac. Bolsonaro disse ainda que não compraria a vacina para o plano nacional por sua "origem". "Da China nós não compraremos. É decisão minha. Não acredito que ela transmita segurança suficiente à população pela sua origem. Esse é o pensamento nosso", disse ele em 21 de outubro à Rádio Jovem Pan.
A vacina, porém, foi comprada pelo governo federal em 8 de janeiro de 2021. Sem garantias sobre a data em que a Índia irá liberar a importação da vacina de Oxford/AstraZeneca, apenas a Coronavac tornou-se opção viável para começar imediatamente a vacinação no País. O ministério, então, pede para o Butantan entregar imediatamente todas as 6 milhões de doses da Coronavac que estão prontas para uso. O governo de São Paulo respondeu que enviará esta carga, mas pede para que as doses que serão aplicadas na população paulista sigam no Estado. O impasse pode parar na Justiça, reconhecem autoridades dos dois lados da disputa.
Oxford/AstraZeneca
Também com uso emergencial aprovado por unanimidade, a eficácia geral da vacina de Oxford/AstraZeneca é de 70,42%, segundo calculou a Anvisa. O dado considera mais de uma forma de aplicação e intervalo entre doses. No Brasil, com duas doses, a eficácia ficou em 62%.
A importação das doses prontas, porém, foi adiada pelo governo da Índia. O presidente Bolsonaro disse na sexta-feira, 15, que a entrega deve levar mais dois ou três dias, mas o governo não confirma nem sequer em que data o voo que em direção à Índia deixará o Brasil para receber esta vacina. O governo indiano aponta "problemas logísticos" para a entrega da vacina, pois simultaneamente está começando a sua própria campanha de imunização.
Além das duas milhões de doses prontas, a Fiocruz deve receber ingrediente para fabricar cerca de 100,4 milhões de doses neste primeiro semestre, mas a entrega está atrasada. No segundo semestre, o laboratório brasileiro quer produzir 110 milhões de doses de ponta a ponta. A ideia é que estas doses sejam liberadas só em meados de fevereiro, mas o uso das doses fabricadas no País não foram objeto do pedido à Anvisa avaliado neste domingo, 17. Ou seja, seria preciso nova avaliação da agência.
Sem a vacina de Oxford em mãos, a campanha de imunização deve começar com a Coronavac, vacina desenvolvida pela farmacêutica Sinovac e distribuída no Brasil pelo Instituto Butantan.
O Ministério da Saúde planeja começar a campanha nacional na quarta-feira, 20, às 10h. Como revelou o Estadão, o Palácio do Planalto pode receber uma cerimônia, na terça-feira, 19, para marcar o começo da campanha. Não está descartado aplicar a primeira dose durante este evento, mas a pressão pela crise em Manaus (AM) pode levar o governo a desistir da cerimônia em Brasília.
Anvisa: pelo estágio da pandemia, vacinas têm benefícios apesar da falta de dados
O gerente-geral de Medicamentos e Produtos Biológicos da Agência Nacional de Vigilância Sanitária (Anvisa), Gustavo Mendes, disse neste domingo, 17, que, apesar da falta de dados sobre as vacinas Coronavac e a de Oxford/AstraZeneca, o uso das mesmas teria benefícios pelo estágio da pandemia no Brasil e ausência de uma alternativa terapêutica contra a covid-19.
A área técnica do órgão regulador recomendou neste domingo, 17, a aprovação do uso emergencial das duas vacinas. Os cinco diretores da agência ainda vão votar se aprovam ou não o uso da vacina. Nos dois casos, a recomendação foi para aprovação com monitoramento das "incertezas e reavaliação periódica" dos dados o imunizante.
A eficácia geral da vacina de Oxford/AstraZeneca é de 70,42%, calculou a agência. O dado considera mais de uma forma de aplicação e intervalo entre doses. No Brasil, com duas doses, a eficácia ficou em 62%. No caso da Coronavac, a eficácia calculada é de 50,39%.
Mendes apontou uma série de lacunas de dados para comprovar que o produto importado da Índia é equivalente ao que a AstraZeneca pretende, no futuro, registrar no Brasil. "Pode constituir produtos diferentes, ainda que possuam categorias similares."
Entre eles, dados sobre a duração da eficácia e segurança no longo prazo. Segundo a Anvisa, nem sequer foram apresentados números gerais sobre controle de qualidade do lote que deve vir da Índia. A AstraZeneca apresentou informações de "outros fabricantes, para os quais pretende solicitar registro em breve"
Mendes afirmou que há dúvidas sobre a eficácia na população acima de 65 anos. Também sobre resultados do uso de doses mais baixas ou da aplicação de apenas uma dose.
"Dados sobre intervalo de doses são limitados. Não conseguimos concluir sobre eficácia quando intervalo é menor do que oito semanas", disse.
Mendes ainda afirmou que os dados não permitem conclusões sobre a eficácia na forma mais grave da doenças. "Existe tendência favorável à proteção, mas precisamos acompanhar mais de perto."
O uso destas doses era a aposta do presidente Jair Bolsonaro e do ministro da Saúde, Eduardo Pazuello, para colocar o carimbo do governo federal na "primeira foto" da imunização contra a covid-19 no Brasil. O produto será distribuído pela Fiocruz no Brasil.
A importação das doses prontas, porém, foi adiada pelo governo da Índia. O presidente Bolsonaro disse na sexta-feira, 15, que a entrega deve levar mais dois ou três dias, mas o governo não confirma nem sequer em que data o voo que em direção à Índia deixará o Brasil para receber esta vacina. O governo indiano aponta "problemas logísticos" para a entrega da vacina, pois simultaneamente está começando a sua própria campanha de imunização.
Além das duas milhões de doses prontas, a Fiocruz deve receber ingrediente para fabricar cerca de 100,4 milhões de doses neste primeiro semestre, mas a entrega está atrasada. No segundo semestre, o laboratório brasileiro quer produzir 110 milhões de doses de ponta a ponta. A ideia é que estas doses sejam liberadas só em meados de fevereiro, mas o uso das doses fabricadas no País não foram objeto do pedido à Anvisa avaliado neste domingo, 17. Ou seja, seria preciso nova avaliação da agência.