Anvisa tem 30 dias para decidir sobre importação de Sputnik V
O imunizante é produzido pelo Instituto Gamaleya da Rússia
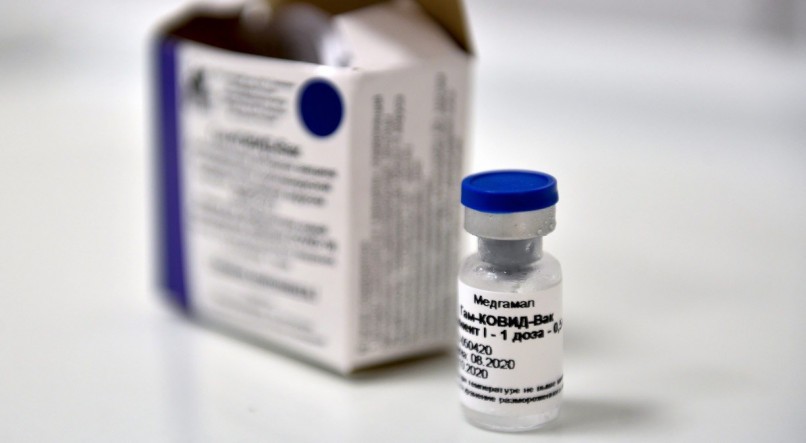
O ministro do Supremo Tribunal Federal (STF) Ricardo Lewandowski definiu nesta terça-feira (13) prazo de 30 dias para que a Agência Nacional de Vigilância Sanitária (Anvisa) decida sobre o pedido do governo do Maranhão para importar a vacina Sputnik V, usada na imunização contra a covid-19. O imunizante é produzido pelo Instituto Gamaleya da Rússia.![]()
![]()
O prazo definido pelo ministro é contado a partir de 29 de março, data do protocolo do pedido de autorização excepcional de uso e de importação da vacina e que também foi definido pela Lei 14.124/2021.
>> Consórcio da FNP anuncia negociação de 30 milhões de doses da Sputnik V
Pela decisão, se o prazo de análise não for cumprido pela Anvisa, o governo local fica autorizado a importar o imunizante e fazer a aplicação na população "sob sua exclusiva responsabilidade, e desde que observadas as cautelas e recomendações do fabricante e das autoridades médicas".
"Entendo que a importação de vacinas pelo estado do Maranhão representará um importante reforço às ações desenvolvidas sob os auspícios do Plano Nacional de Imunização, notoriamente insuficientes, diante da surpreendente dinâmica de propagação do vírus causador da pandemia", decidiu o ministro.
- Sem Covaxin e Sputnik V, Brasil só se vacina mesmo é com Coronavac e AstraZeneca
- Pernambuco e mais oito estados entregam à Anvisa pedido de importação da vacina contra covid-19 Sputnik V
- Conversa de Putin com Bolsonaro ajuda e uso da Sputnik V no Brasil agora só depende do parceiro brasileiro
- Governadores do Nordeste mostram insatisfação após reunião com a Anvisa e cobram celeridade na liberação da Sputnik V
- Governadores temem que Anvisa atrase liberação da Sputnik V para comprar vacina e ficar com o protagonismo
Em nota divulgada no dia 10 de abril, a Anvisa informou que os pedidos de importação da vacina Sputnik V estão em análise e não foram negados ou decididos. De acordo com a agência, alguns documentos necessários não foram entregues, como relatórios técnicos sobre segurança e eficácia da vacina.
A Agência Brasil entrou em contato com a Anvisa e aguarda retorno.
