Anvisa facilita processo para aprovar uso emergencial de vacinas contra covid-19
Agora, estudo de fase 3 no Brasil deixa de ser obrigatório para uso emergencial de vacinas contra covid-19
Atualizada às 19h57
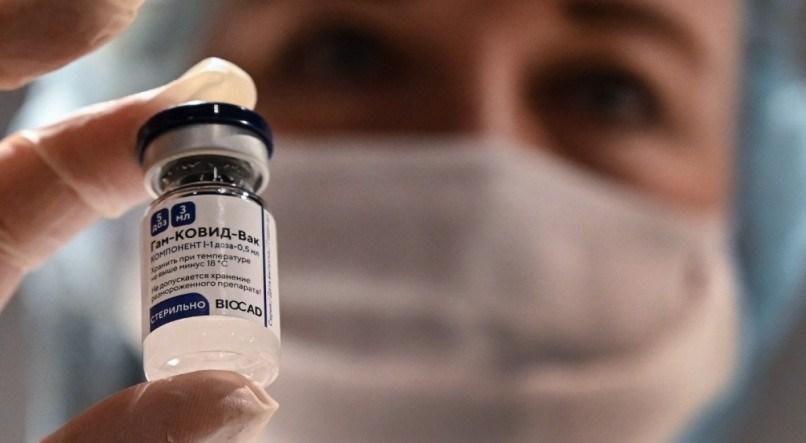
A Agência Nacional de Vigilância Sanitária (Anvisa) decidiu mudar regras para que empresas peçam o uso emergencial de vacinas para covid-19 no Brasil, o que pode facilitar a entrada da Sputnik V. A agência informou, nesta quarta-feira (3), que retirou a exigência de que estudos de fase 3 estejam em andamento no País para conceder este aval, passando a se valer de dados de estudos conduzidos internacionalmente.
>> Sputinik V e Covaxin: Ministério da Saúde negocia aquisição de 30 milhões de doses das vacinas
>> Covid-19: Pernambuco vacina mais da metade dos idosos a partir de 85 anos
A Anvisa informou, nesta quarta-feira (3), que o prazo para análise de uso emergencial nessas condições deverá ser de 30 dias. Para as vacinas com estudos nacionais, o prazo da agência foi de dez dias, como nos casos da Coronavac e do imunizante de Oxford/AstraZeneca, que obtiveram autorização em janeiro. A justificativa para o aumento do prazo é que, no caso dos estudos nacionais, houve acompanhamento mais próximo, o que facilitou a análise. Para os estudos conduzidos fora do País, será necessário analisar dados de pesquisas desde a fase inicial até a mais o estágio mais avançado, que não tiveram acompanhamento prévio.
- Covid-19: Butantan recebe insumos para 8,6 milhões de doses da vacina nesta quarta (3)
- Governo está preparado para executar plano nacional de vacinação, diz Bolsonaro no Congresso
- Brasil garante mais 10,6 milhões de doses de vacinas contra covid-19 por meio do consórcio Covax Facility
- Covid-19: Pernambuco vacina mais da metade dos idosos a partir de 85 anos
- Sputinik V e Covaxin: Ministério da Saúde negocia aquisição de 30 milhões de doses das vacinas
A discussão ocorre no momento em que a Anvisa é pressionada para liberar o uso do imunizante, desenvolvido pelo Instituto Gamaleya, da Rússia. No Brasil, a União Química afirma que pode receber 10 milhões de doses prontas do imunizante até março. Além disso, entregar 150 milhões de unidades em 2021, somando a produção que seria feita no Brasil.
A retirada desta exigência também pode facilitar a entrada de outras vacinas no País. O laboratório indiano Bharat Biotech, por exemplo, já mostrou interesse em trazer a Covaxin ao setor público e privado brasileiro. A diretoria da Anvisa lembrou que o Brasil é elegível para receber diferentes vacinas pelo consórcio Covax Facility. Assim, a mudança na exigência da análise pode passar a englobar eventualmente imunizantes como o da Moderna e a Novavax.
"Os resultados publicado no The Lancet sobre a eficácia da vacina russa Sputnik V, com resultado de 91,6% do imunizante em duas doses, acendeu mais uma esperança. Na Alemanha, Angela Merkel afirmou que as vacinas aprovadas pelo regulador de medicamentos da União Europeia seriam bem-vindas", diz o médico Eduardo Jorge da Fonseca Lima, integrante dos comitês de imunização contra o coronavírus no Recife e em Pernambuco. Ele acredita que vacinas aprovadas pelas principais agências reguladoras do mundo, como o FDA e EMA, na União Europeia, deveriam ter sua aprovação facilitada no Brasil pela dificuldade de se conseguir vacinas em número suficiente no Brasil.
"A preocupação com o surgimento de novas variantes e o baixo ritmo da velocidade da vacinação, no País, pela falta das vacinas, são riscos que devemos reduzir. Sou a favor que qualquer vacina aprovada por grandes agências internacionais e com publicações de estudo de fase 3, em revistas de relevância e revisada por pares, possa ser liberada no Brasil devido à gravidade da pandemia", destaca Eduardo Jorge.
A Sputnik V tem eficácia de 91,6% contra casos sintomáticos da covid-19. Os dados, avaliados por pesquisadores independentes, foram publicados na terça-feira, 2, na revista científica The Lancet. A vacina já está sendo aplicada na Rússia e em outros países, como Argentina e Argélia.
Questionada sobre a motivação para a mudança nos critérios diante da aparente pressão pela Sputnik V, a diretora da Anvisa Meiruze Freitas disse que a alteração "não tem nada a ver com a decisão de publicação do Lancet, diria que foi coincidência". "O processo está sendo discutido há mais tempo. Não foi pleito de nenhuma empresa, do governo, do Ministério da Saúde", acrescentou.
Mesmo sem a exigência da fase 3 de pesquisa, a Anvisa ainda aguarda dados de segurança e eficácia da Sputnik V. Ao Supremo Tribunal Federal (STF), a agência aponta a falta de dados básicos da vacina. Já a União Química chama, na mesma ação, as cobranças da Anvisa de "exageradas". O governo federal tem apostado na compra da Sputnik V, que nos bastidores tem sido vista como uma possível "vacina de Bolsonaro.
A agência, hoje, cobra em seu guia para submissão do pedido de uso emergencial que estudos finais da vacina estejam pelo menos sendo conduzidos no Brasil. Por esta regra, apenas as vacinas de Oxford/AstraZeneca, a Coronavac e os imunizantes da Janssen e da Pfizer podem solicitar o uso emergencial. Como o Estadão mostrou, porém, os diretores da Anvisa já apontavam a cobrança da fase 3 como uma barreira que pode ser dissolvida, caso os imunizantes recebam alguma qualificação de agências reguladoras de peso ou entreguem dados robustos de segurança e eficácia.
O Congresso também tem pressionado a Anvisa. Como mostrou a Coluna do Estadão, o líder do governo na Câmara e ex-ministro da Saúde, Ricardo Barros (PP-PR), trabalha em projeto para suspender a exigência de pesquisa no Brasil. Além disso, o Congresso deve inserir em medida provisória a possibilidade de a Anvisa aceitar autorização excepcional para importação e distribuição no Brasil de vacinas aprovadas pelas agências sanitárias da Rússia e da Argentina. O governo da Bahia também foi ao Supremo Tribunal Federal (STF) para tentar liberar a Sputnik V.











